为什么我们会感觉到饥饿?科学家们解开了这一难题
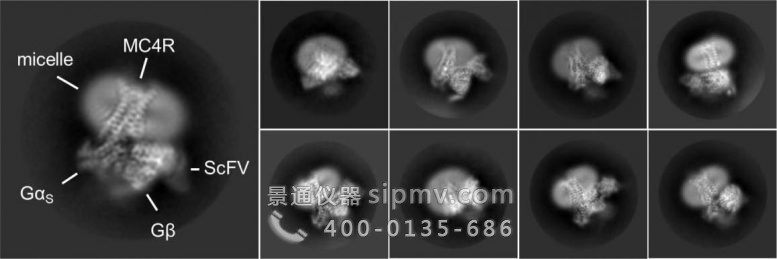
代表与 setmelanotide 结合的 MC4 受体的不同视图的电子显微镜图像,与通过结合激活的蛋白质复合。图片来源:魏茨曼科学研究所
3D 结构揭示了我们大脑中独特的分子开关如何让我们感到饱足——并且可能有助于开发改进的抗肥胖药物。
无论你吃多少,不断饥饿是大脑食欲控制有遗传缺陷的人的日常斗争,而且往往以严重的肥胖告终。在 2021 年 4 月 15 日发表在《科学》杂志上的一项研究中,魏茨曼科学研究所的研究人员与伦敦玛丽女王大学和耶路撒冷希伯来大学的同事一起,揭示了饥饿总开关的作用机制大脑:黑皮质素受体4,简称MC4受体。他们还阐明了这种开关是如何被 setmelanotide (Imcivree) 激活的,这种药物最近被批准用于治疗由某些基因变化引起的严重肥胖症。这些发现为调节饥饿的方式提供了新的思路,并可能有助于开发改进的抗肥胖药物。
MC4 受体存在于称为下丘脑的大脑区域——在一组神经元中,这些神经元通过处理各种与能量相关的代谢信号来计算身体的能量平衡。当 MC4 被激活或“开启”时——通常情况下——它会发出使我们感到饱腹的命令,这意味着从大脑的角度来看,我们的默认状态是饱腹感。当我们的能量水平下降时,下丘脑群会产生一种“进食时间”激素,它会灭活或关闭 MC4 受体,发出“变得饥饿”的信号。我们吃完后,会释放第二个“我吃饱了”的荷尔蒙。它与 MC4 上的同一个活性位点结合,取代饥饿激素并重新打开受体——让我们回到饱腹感默认状态。使 MC4 失活的突变会导致人们不断感到饥饿。

(左到右)Oksana Degtjarik 博士 Moran Shalev-Benami 和 Hadar Israel。图片来源:魏茨曼科学研究所
MC4 是抗肥胖药物(如 setmelanotide)的主要目标,正是因为它是一个主开关:打开它可以控制饥饿感,同时绕过所有其他与能量相关的信号。但直到现在还不清楚这种饥饿开关究竟是如何工作的。
这项新研究从一个家庭的困境开始,其中至少有八名成员因持续饥饿而严重肥胖——其中大多数人的体重指数超过 70,即大约是正常值的三倍。他们的病史引起了 Hadar Israel 的注意,Hadar Israel 是一名在耶路撒冷希伯来大学 Danny Ben-Zvi 博士的指导下攻读肥胖机制博士研究的医学生。以色列人对这个家庭的困境是由于家族中发生的一个突变引起的这一事实感到震惊:一个影响 MC4 受体的突变。她转向魏茨曼化学和结构生物学系的 Moran Shalev-Benami 博士,询问电子显微镜的新进展是否有助于解释这种特殊突变如何产生如此毁灭性的影响。
MC4 正是抗肥胖药物的主要目标,因为它是一个总开关:打开它可以控制饥饿,同时绕过所有其他与能量相关的信号。
Shalev-Benami 决定启动一项对 MC4 受体结构的研究,邀请以色列作为访问科学家加入她的实验室。以色列与实验室博士后研究员 Oksana Degtjarik 博士一起从细胞膜中分离出大量纯 MC4 受体,使其与 setmelanotide 结合,并使用低温电子显微镜确定其 3D 结构。该研究是与伦敦玛丽女王大学的 Peter J. McCormick 博士和耶路撒冷希伯来大学的 Masha Y. Niv 教授的团队合作进行的。
3D 结构显示,setmelanotide 通过进入其结合口袋来激活 MC4 受体——也就是说,通过直接击中发出饱腹感信号的分子开关,甚至比天然饱腹感激素更有效。事实证明,这种药物还有一个令人惊讶的帮手:进入口袋的钙离子,增强了药物与受体的结合。在生化和计算实验中,科学家们发现,与药物类似,钙也有助于天然饱腹激素。
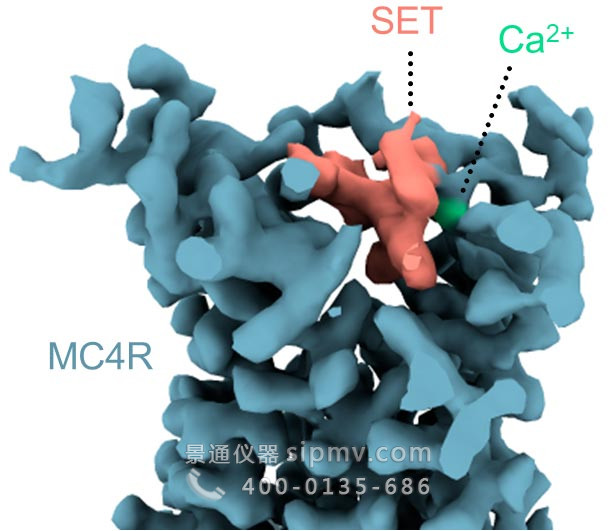
3D 结构显示 MC4 受体结合袋中的 setmelanotide 分子(粉红色)和钙离子(绿色)。图片来源:魏茨曼科学研究所
McCormick:“钙帮助饱腹激素激活 MC4 受体,同时干扰饥饿激素并降低其活性。”
现在需要在碳钢表面制备含有多种合金元素的合金层,不知有什么好的办法没?
“这真是一个出乎意料的发现,”Shalev-Benami 说。“显然,饱腹信号可以成功地与饥饿信号竞争,因为它得益于钙的帮助,这有助于大脑在我们进食后恢复‘我已经饱了’的感觉。”
MC4 的结构还揭示了药物的进入导致受体的结构变化。这些变化似乎启动了神经元内导致饱腹感的信号。该研究解释了 MC4 受体的突变如何干扰这种信号传导,导致永无止境的饥饿并最终导致肥胖。
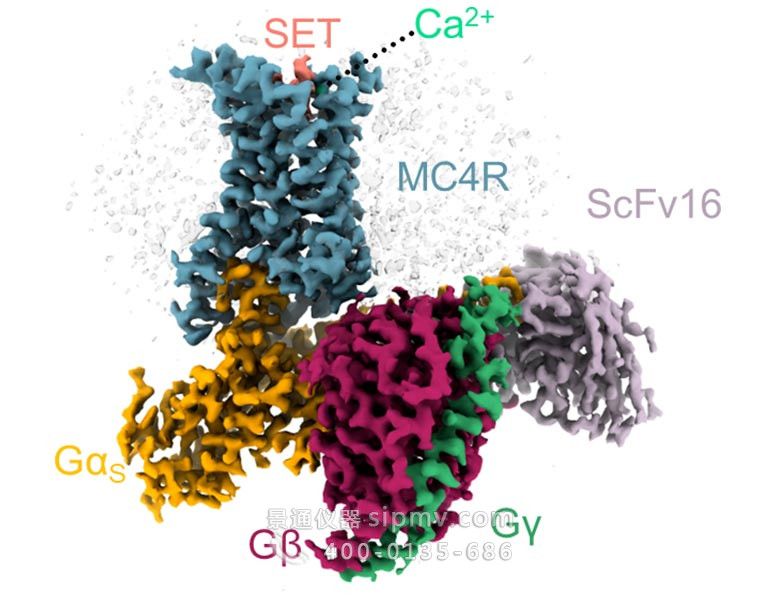
由 MC4 受体(蓝色)和它激活的几种蛋白质形成的复合物的 3D 结构,在 MC4 的结合袋中带有一个 setmelanotide 分子(粉红色)和一个钙离子(绿色)。图片来源:魏茨曼科学研究所
相关仪器: 精密研磨抛光机
此外,科学家们已经确定了将 MC4 与同一家族中的类似受体区分开来的热点。这应该可以设计出仅与 MC4 结合的药物,避免可能由与其他受体相互作用引起的副作用。
“我们的研究结果可以帮助开发改进和更安全的抗肥胖药物,以更精确地靶向 MC4,”Shalev-Benami 说。
类似内容推荐
- 科学家在DNA中构建生物阀门以控制细胞信息流
- 饥饿游戏:科学家揭开大脑中饥饿开关的秘密
- 科学家尝试使用核磁共振波谱 (NMR)构建SARS-CoV-2分子的三维结构
- 研究人员已确定了一种控制细胞生长和存活的细胞通讯途径
- 新算法可以作为分析生物系统模型的更有效方法
- 科学家发现神经免疫相互作用如何燃烧深层脂肪
- 科学家首次对人类基因组进行了完整测序
- 科学家实现了微磁体远程控制脑细胞
- 科学家们发现了变异的冠状病毒蛋白复合物
- 科学家创造了由人类细胞制成的“时间机器”来逆转胰腺癌的扩散
- 植物科学家在百里香和牛至等草药中找到抗癌化合物的配方
- 与嗅觉有关的基因可能在乳腺癌向大脑的传播中发挥作用
- 研究人员开发出一种双光子显微镜可用来监测大脑神经元
- 打破光学显微镜极限的科学家
版权属于:景通仪器 - 国内领先的显微镜与显微数字成像解决方案供应商
转载时必须以链接形式注明作者和原始出处及本声明。
本文地址:http://www.sipmv.com/blog/3437/